Orbitálne pasce vo vývoji biofarmák
Biofarmaká zaujímajú vedľa kompletne synteticky pripravených látok významnú a stále expandujúcu oblasť na poli liečiv. Môže sa jednať o krv a krvné komponenty, bunky, tkanivá, vakcíny či celé živé organizmy, ale hlavne o monoklonálne protilátky (mAb, štruktúra bielkovín) a fúzne proteíny, ktoré na trhu podľa serveru PharmaCompass dominujú. Vďaka nim sa posledné roky biofarmaká umiestňujú v rebríčkoch najpredávanejších (podľa objemu peňazí) liečiv na popredných priečkach a v minulom roku sa ich v prvej desiatke umiestnilo úctyhodných šesť (pozri Obr. 1). Biologická liečba (teda taká, kde sú použité biofarmaká) našla nezastupiteľnú úlohu vo zvyšovaní kvality života pri onkologickej a imunologickej terapii nielen vďaka svojej efektivite, ale hlavne vďaka minimalizácie vedľajších účinkov.
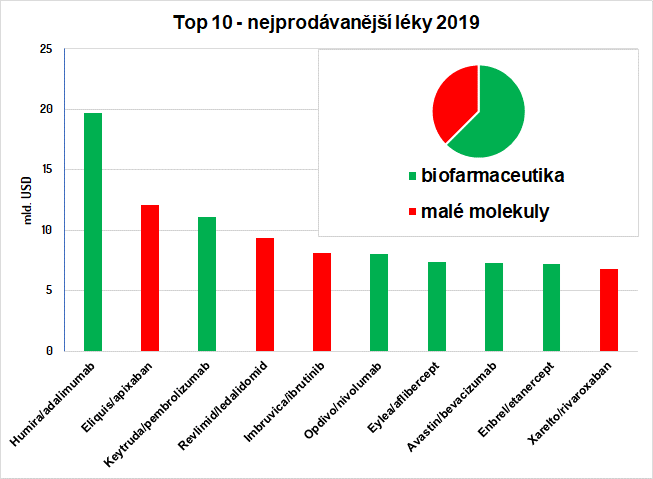
Obr. 1: Najpredávanejšie lieky/účinné látky v roku 2019 podľa serveru pharmacompass.com
Vakcíny nikdy nepatrili k hlavným ťahúňom farmaceutického priemyslu, čo sa však môže čoskoro zmeniť vďaka súčasnému celosvetovému rozšíreniu koronavírusu. Nemožno opomenúť fakt, že významní potenciálni producenti očkovacích látok proti SARS-CoV-2 vírusu nekonštruujú vakcínu na báze oslabených či mŕtvych vírusov ako je bežne zvykom, ale na základe produkcie ( in vitro v bioreaktoroch alebo in vivo v tele po vakcinácii) tzv. „spike“ proteínov („satelitné štruktúry“ na povrchu vírusu, pozri Obr. 2), ktoré majú prítomnosť koronavírusu navodiť a naštartovať požadovanú imunitnú reakciu.
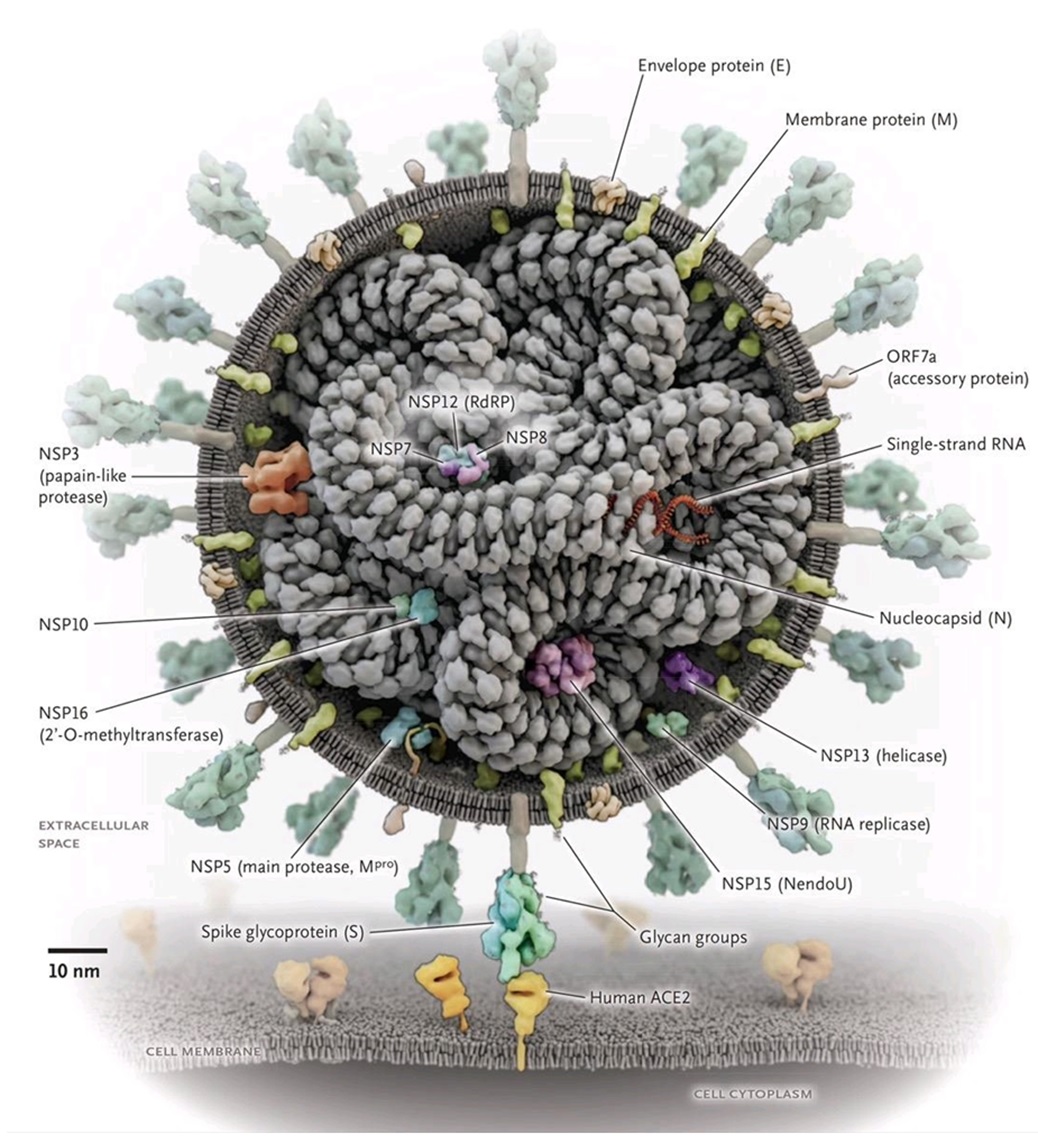
Obr. 2: Skladba SARS-CoV-2 vírusu spolu s proteínovými štruktúrami (N Engl J Med 2020; 382:2261-2264)
V kontexte s vyššie uvedenými skutočnosťami stoja analytickí chemici pred úlohou, ako zvládnuť charakterizáciu a následnú kvantifikáciu účinných látok a potenciálnych nečistôt. Špecialisti prichádzajúci z prostredia ortodoxných molekulárne biologických techník nastavili a formálne v direktívach ukotvili praktické a v istých medziach aj dostatočné kritériá pomocou techník ako je ELISA a SDS-PAGE. Iní špecialisti (rokmi bičovaní regulami kvality syntetických molekúl), ktorí využívajú moderné chromatografické postupy s vysoko rozlišovacou hmotnostnou spektrometriou (HRMS), bývajú často zaskočení, udivení a navrhujú nekompromisné zásahy založené na masívnom využití platformy HRMS. Veď aj k biologickým liekom možno pristupovať v komplexnom analytickom poňatí (aj najpredávanejšiu účinnú bio-látku adalimumab možno opísať sumárnym vzorcom C 6428 H 9912 N 1694 O 1987 S 46 ).
Prvý logický krok s HRMS prístupom sa ponúka vykonať chromatografickú separáciu na reverznej fáze s následnou hmotnostne spektrometrickou analýzou. Tu platí pravidlo o nastavení čo najväčšieho rozlíšenia na hmotnostnom spektrometri (bežne 150 000, najlepšie > 200 000 FWHM), čomu vyhovujú spektrometre s iónovou cyklotrónovou rezonanciou alebo orbitálnou pascou. Vďaka cenovej dostupnosti, bench-top usporiadaniu a nízkym prevádzkovým nákladom sa orbitrapy (pozri Obr. 3) stávajú prvou voľbou. Krásne vykreslená obálka rôznych nábojových stavov monoklonálnej protilátky v stave denaturovanom a natívnom je znázornená na Obr 4. Zaujímavé zistenie prinesie zoom jedného nábojového klastra, resp. spektrum po dekonvolúcii, kde možno pozorovať glykozylažné adukty (líšiace sa počtom naviazaných galaktózových jednotiek, t.j. s hmotnostným rozdielom 162), produkty posttranslačnej modifikácie pri bioprodukcii. Detailné štúdium glykozylácie môže byť vykonané iónovo-chromatografickou separáciou po kyslej hydrolýze (analýza monosacharidov) alebo po glykozidázovom štiepení (analýza glykánov/oligosacharidov) alebo proteomickým „bottom-up“ prístupom.
Ďalší krok pri charakterizácii biofarmák by mal smerovať k ortogonálnej separácii (proti reverznej fáze) na iónomeniči. Pretože monoklonálne protilátky a fúzne proteíny majú vďaka prítomnosti amino- a karboxylových skupín dostatočný náboj v širokom rozmedzí pH, očakáva sa zaujímavý profil, pretože na základe poznatkov z glykozylačných štúdií podliehajú biofarmaká rozsiahlym posttranslačným modifikáciám. Výsledok je prekvapujúci: vďaka väzbe až dvoch molekúl lyzínu na C-koniec protilátky a procesu viacnásobnej deamidácie aminokyselín asparagínu a glutamínu v reťazci proteínu dochádza k tvorbe (a nie na úrovni stopových množstiev) rôzne nabitých variantov oddeliteľných aj chromatograficky, aj pomocou hmotnostnej spektrometrie, viď Obr. 6, 7 a 8.
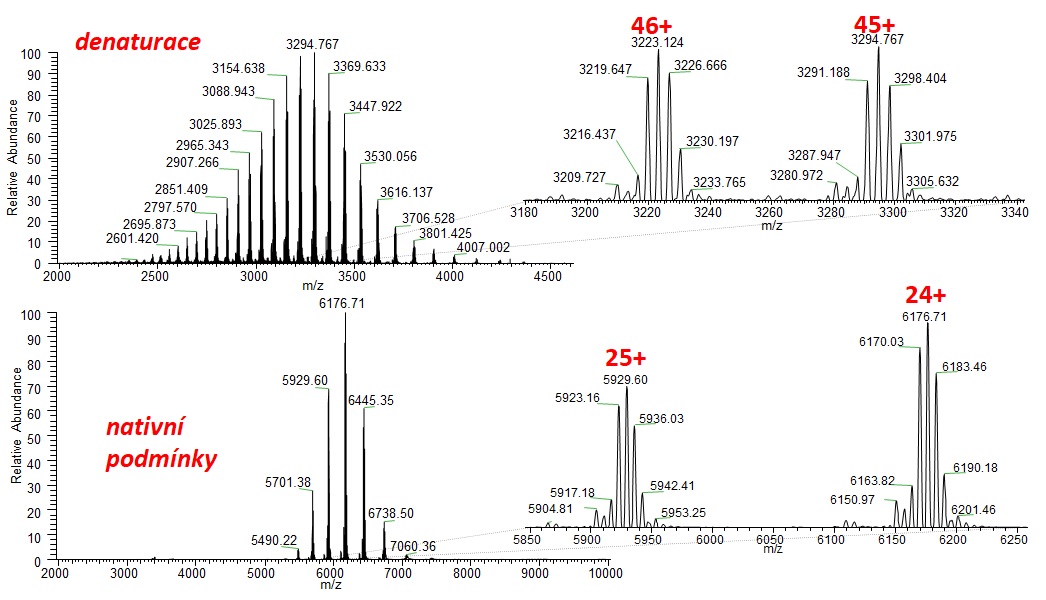
Obr. 3: Hmotnostné spektrum adalimumabu, ESI+, rozlíšenie 200 000 FWHM, orbitálna pasca
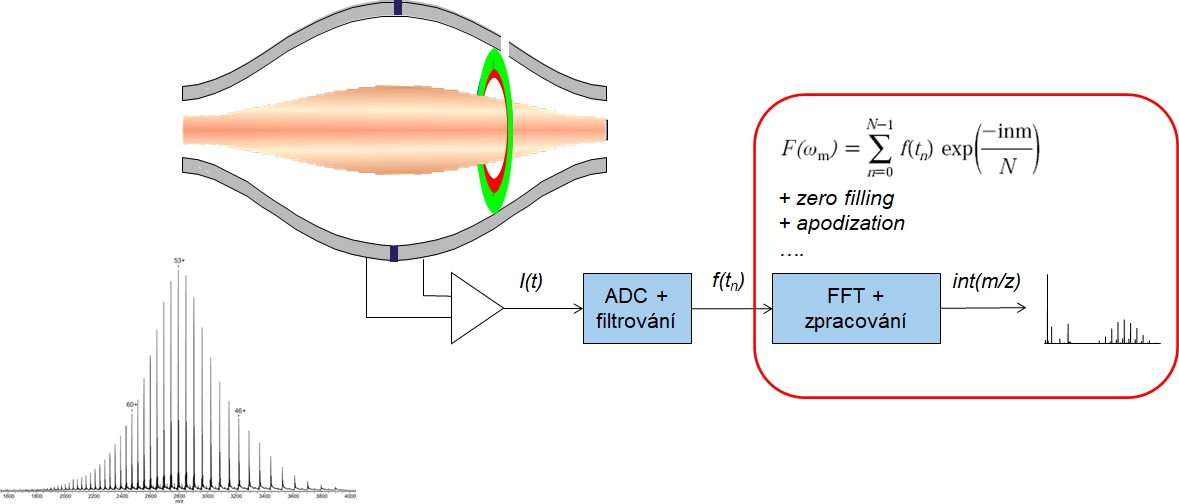
Obr. 4: Princíp detekcie a spracovania signálu na orbitálnej iónovej pasci
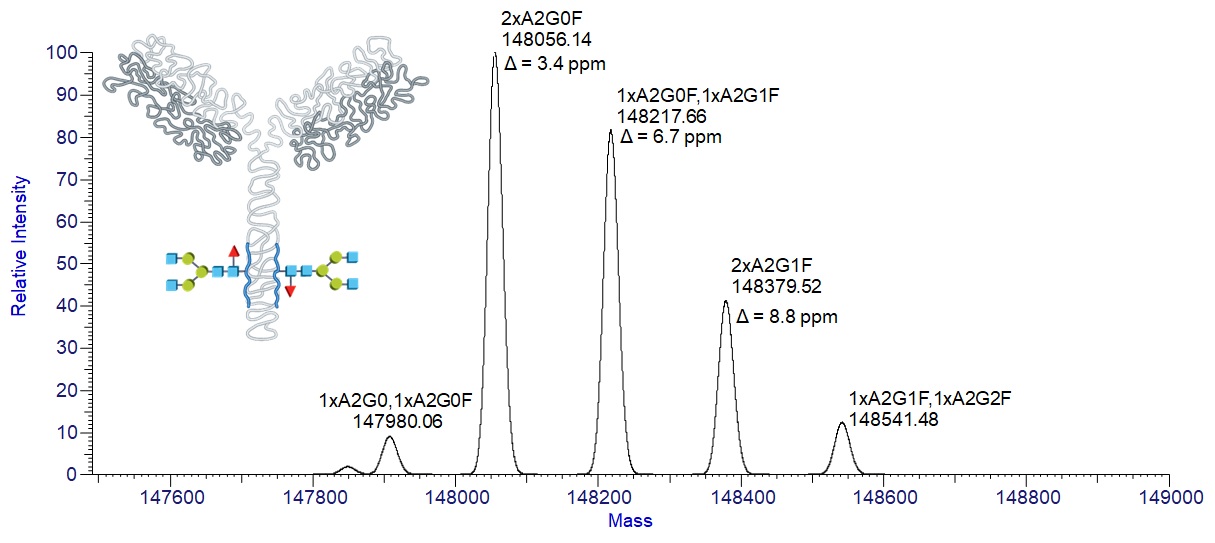
Obr. 5: Glykozylačné adukty adalimumabu (líšiace sa počtom naviazaných galaktózových jednotiek, tj. s hmotnostným rozdielom 162), produkty posttranslačnej modifikácie pri bioprodukcii
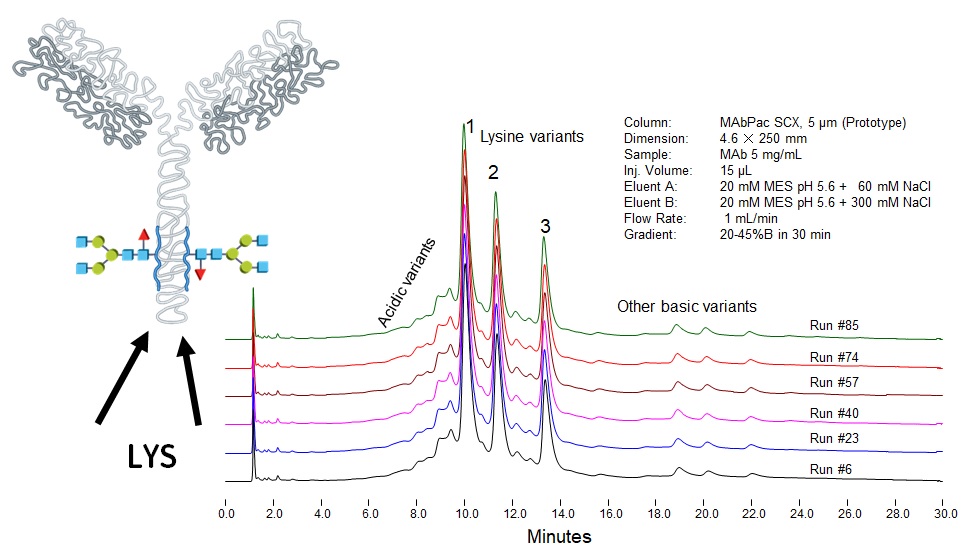
Obr. 6: Chromatografická separácia finálnej monoklonálnej protilátky na iónomeniči, odhaľujúca prítomnosť nábojových variantov
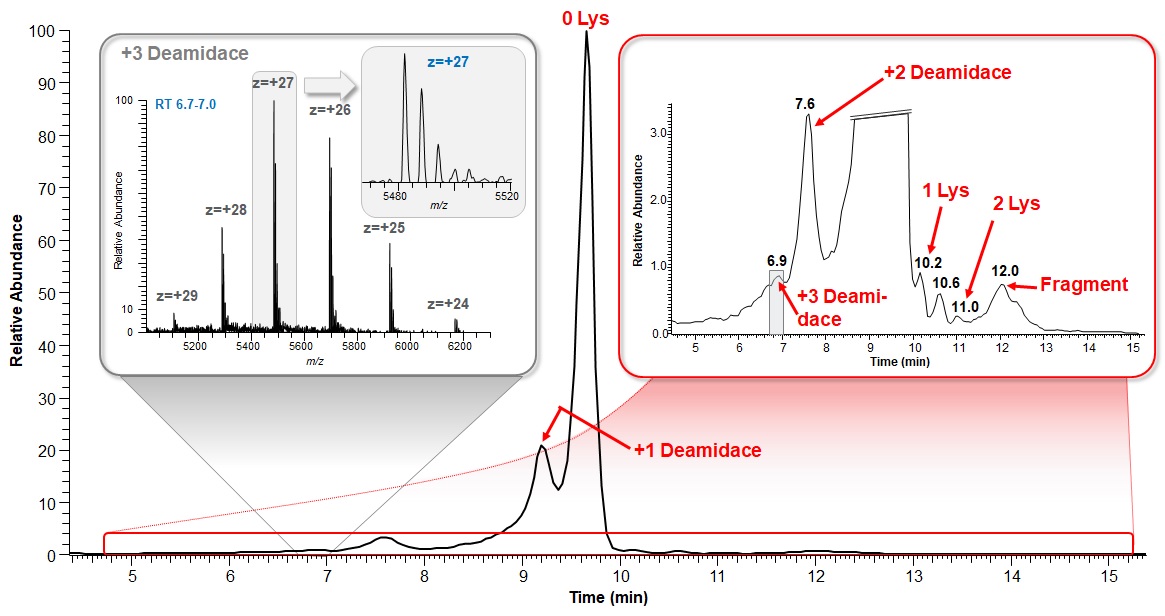
Obr. 7: Chromatografická separácia adalimumabu na iónomeniči, odhaľujúca prítomnosť nábojových variantov (deamidácia + lyzínové modifikanty); HRMS spektrum dokladuje charakterizáciu trojnásobného deamidačného produktu, navyše glykozylovaného, na nízkej koncentračnej úrovni
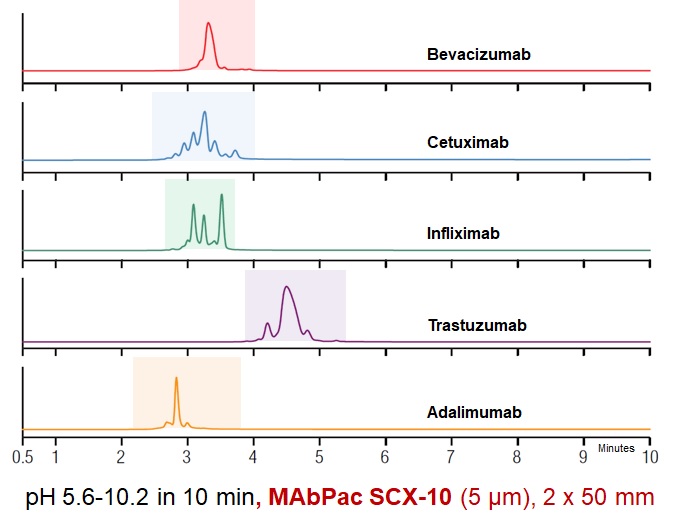
Obr. 8: Profily jednotlivých finálnych foriem komerčne dostupných biofarmák z pohľadu prítomnosti nábojových variantov z procesu posttranslačnej modifikácie
Štúdium ďalších a ďalších modifikácií biofarmák sa zdá byť bez hraníc. S orbitálnymi pascami možno odhaľovať oxidácie na metioníne a tryptofáne, tvorbu pyroglutamátov alebo napr. rozpad disulfidickej väzby; významná kapitola odhaľovania nečistôt pri bioprocese je tiež detekcia a následná eliminácia proteínov z hostiteľskej bunky (host cell proteins). Podpora a implementácia moderných chromatografických a hmotnostne spektrometrických postupov sa stáva kľúčom k úspešnému analytickému zvládnutiu problematiky charakterizácie a kvantifikácie biofarmák a príbuzných nečistôt.
Nenechajte si ujsť ďalšie zaujímavosti
- Thermo Scientific SMART chromatografické striekačky
- LC-MS/MS kvantifikácia voľných metanefrínov v ľudskej plazme pre klinický výskum
- Kvantifikácia ôsmich antimykotík v ľudskej plazme pomocou kvapalinovej chromatografie - tandemovej hmotnostnej spektrometrie pre klinický výskum
- Biopsia dychu pomocou technológie GC-Orbitrap – neinvazívny prístup k odhaleniu choroby?
- Ultrazvuková pasterizácia omáčok, džúsov a nápojov